
|

| 产地 | 中国 |
| 品牌 | Frdbio |
| 货号 | IGP0011 |
| 用途 | |
| 包装规格 | ml |
| 纯度 | % |
| CAS编号 | |
| 是否进口 | 否 |
一. 产品介绍
Protein A Agorase Beads 是用于分离和纯化单克隆抗体的亲和层析介质,具体性能见表1。Protein A 是一种分离自金黄色葡萄球菌的细胞壁蛋白,主要通过Fc 片段结合哺乳动物IgG。Protein A Agorase Beads 的配体蛋白Protein A 是在天然蛋白A 的基础上进行生物工程突变得到的一种耐碱蛋白A(Alkaline tolerate,故缩写为At)。
该产品以0.1M NaOH 进行200 次在位清洗,介质载量几乎不变,以0.5M NaOH 进行100 次在位清洗,载量仍可达到最初载量的80%,更加方便客户尤其是工业客户的清洗操作。该产品采用较稳定的定向偶联,脱落量低(小于10ng/mg IgG,见图1)。
Protein A Agorase Beads 是以高度交联的4%琼脂糖凝胶为基质,可以在相对较高的流速下进行单克隆抗体和多克隆抗体的纯化,其耐压性能见图2,因此Protein A Agorase Beads 适用于工业化抗体的大规模生产。
表1. Protein A Agorase Beads 产品性能
项目 | 性能 |
介质 | 高度交联的4%琼脂糖 |
平均粒径 | ~90μm |
配体 | 耐碱性Protein A |
结合载量 | > 40 mg 人lgG/ml 介质 |
化学稳定性 | 可耐受抗体纯化过程中的所有试剂 |
工作pH | 3-12 |
在线清洗 | 0.1-0.5M NaOH |
线性流速 | 50-300cm/h |
保存 | 20% 乙醇, 2℃ - 8℃ |
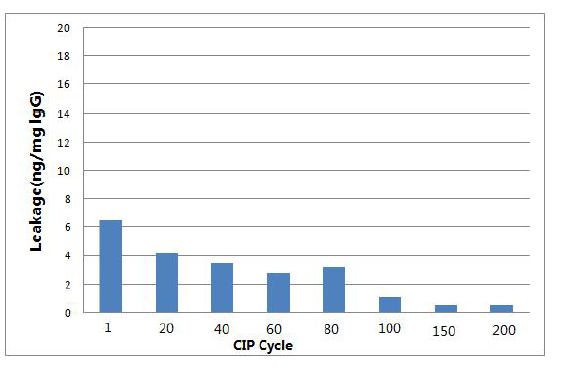
图1. CIP 清洗后Protein At 脱落量
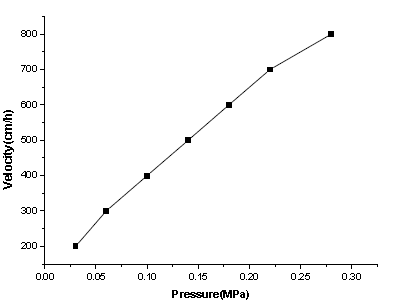
图2.介质的压力/流速曲线(层析柱BPG300,柱高20cm)
二. 纯化流程
1. Buffer 的准备
所用水和Buffer 在使用之前建议用0.22μm 或0.45μm 滤膜过滤。
结合缓冲液/洗涤缓冲液:0.15 M 氯化钠、20 mM 磷酸氢二钠,pH7.0
洗脱液:0.1 M 甘氨酸,pH 3.0
中和液:1 M Tris-HCl 缓冲液,pH 8.5 。
2.样品准备
上柱之前要确保样品溶液有合适的离子强度和pH 值,可以用结合/洗涤缓冲液对血清样品、腹水或细胞培养液稀释,或者样品用结合/洗涤缓冲液透析。样品在上样前建议离心或用0.22μm 或0.45μm 滤膜过滤,减少杂质,提高蛋白纯化效率和防止堵塞柱子。
3. Protein A Agorase Beads 装填
Protein A Agorase Beads 被广泛应用于工业纯化,因此,涉及到各种中压色谱层析柱的填装,下面介绍使用Protein A Agorase Beads 填装层析柱的方法。
层析柱的装填(使用储液器装填)
1). 用去离子水冲洗层析柱底筛板与接头,确保柱底筛板上无气泡,关闭柱底出口,并在柱底部留出1-2cm 的去离子水。
2). 将树脂悬浮起来,小心的将浆液连续地倒入层析柱中。用玻璃棒沿着柱壁倒入浆液可减少气泡的产生。
3). 如果使用储液器,应立即在层析柱和储液器中加满水,将进样分配器放置于浆液表面,连接至泵上,避免在分配器或进样管中产生气泡。
4). 打开层析柱底部出口,开起泵,使其在设定的流速下进行。最初应让缓冲液缓慢流过层析柱,然后缓慢增加至最终流速,这样可避免液压对所形成柱床的冲击,也可以避免柱床形成的不均匀。如果达不到推荐的压力或流速,可以用你所使用泵的*流速,这样也可以得到一个很好的装填效果。(注意:在随后的色谱程序中,不要超过*装柱流速的75%)当柱床高度稳定后,在*的装柱流速下至少再上3 倍柱床体积的去离子水。标上柱床高度。
5). 关闭泵,关闭层析柱出口。
6). 如果使用储液器,去除储液器,将分配器至于层析柱中。
7). 将分配器推向柱子至标记的柱床高度处。允许装柱液进入分配器,锁紧分配器接头。
8). 将装填好的层析柱连接至泵或色谱系统中,开始平衡。如果需要可以重新调整分配器。
4.样品纯化
1). 将Protein A Agorase Beads 装入合适的层析柱,层析用5 倍柱体积的结合Buffer 进行平衡,使填料处于与目的蛋白相同的缓冲体系下,起到保护蛋白的作用。
2). 将样品加到平衡好的Protein A Agorase Beads 中(保证目的蛋白与Protein A Beads4FF 充分接触,提高目的蛋白的回收率),收集流出液。
3). 用10-15 倍柱体积的洗杂Buffer 进行清洗,去除非特异性吸附的杂蛋白,收集洗杂液。
4). 使用5-10 倍柱体积的洗脱Buffer,收集洗脱液,即目的蛋白组分。
5). 依次使用3 倍柱体积的结合Buffer 和5 倍柱体积的去离子水平衡填料,*再用5 倍柱体积的20%的乙醇平衡,然后保存在等体积的20%的乙醇中,置于4 度保存,防止填料被细菌污染。
注:*使用时,可先按照4 填料清洗中CIP 清洗一遍,避免脱落的配体残留。
5.SDS-PAGE 检测
将使用纯化产品得到的样品(包括流出组分、洗杂组分和洗脱组分)以及原始样品使用SDS-PAGE 检测纯化效果。
三. 残留配体去除
Protein A Agorase Beads 配体的脱落很低,小于10ng/mg 抗体。但是很多产品需要完全去除,可采用阳离子交换、阴离子交换或凝胶过滤等方法去除,具体参照阳离子交换树脂、阴离子交换树脂和凝胶过滤树脂的使用。
四. 填料清洗
Protein A Agorase Beads 可以重复使用而无需再生,但随着一些变性物质的沉淀和蛋白的聚集,往往造成流速和结合载量都下降,严重影响柱子的性能,这时需要对树脂进行清洗。
Protein A Agorase Beads 是一种耐碱亲和介质,可以耐受0.1M-0.5M NaOH 溶液的清洗,成本低,效果好,具体操作:
1.3 倍柱体积的结合液;
2.至少2 倍柱体的0.1–0.5 M NaOH,接触时间为15 minutes;
3.5 倍柱体积的结合液冲洗。
注:因0.1–0.5 M NaOH 粘度大易造成压力增加,可进行反向冲洗。
五. 问题及解决方案
问题 | 原因分析 | 推荐解决方案 |
柱子反压过高 | 筛板被堵塞 | 清洗或更换筛板 |
填料被堵塞 | 按照第4部分进行树脂CIP清洗 | |
裂解液中含有微小的固体颗粒,建立上柱前过滤 | ||
样品纯化过程中曲线不稳 | 样品或buffer中有气泡 | 取出样品或柱子中的气泡 |
样品和buffer进行脱气 | ||
洗脱组分中没有目的蛋白 | 样品中抗体浓度太低 | 使用其抗原做配体的介质 |
抗体被降解 | 适当的提高洗脱Ph | |
回收率逐渐减低 | 上样量太多 | 减少上样量 |
柱子太脏 | 按照第4部分进行树脂CIP清洗 |